????? 醫(yī)療器械臨床試驗,是指在符合條件的醫(yī)療器械臨床試驗機構(gòu)中,對擬申請注冊的醫(yī)療器械(含體外診斷試劑)在正常使用條件下的安全性和有效性進(jìn)行確認(rèn)的過程���。根據(jù)新修訂《醫(yī)療器械監(jiān)督管理條例》和《醫(yī)療器械注冊與備案管理辦法》的規(guī)定�,省�����、自治區(qū)����、直轄市藥品監(jiān)督管理部門根據(jù)醫(yī)療器械臨床試驗機構(gòu)備案情況,組織對本行政區(qū)域內(nèi)已經(jīng)備案的臨床試驗機構(gòu)開展備案后監(jiān)督檢查�����,以及對醫(yī)療器械臨床試驗機構(gòu)遵守醫(yī)療器械臨床試驗質(zhì)量管理規(guī)范的情況進(jìn)行日常監(jiān)督檢查�,監(jiān)督其持續(xù)符合規(guī)定要求;并且可以對臨床試驗的真實性�、準(zhǔn)確性、完整性����、規(guī)范性和可追溯性進(jìn)行現(xiàn)場檢查。
??廣東省藥品監(jiān)督管理局在機構(gòu)監(jiān)督管理和臨床試驗項目監(jiān)督管理過程中逐步摸索積累經(jīng)驗�,建立了常態(tài)化監(jiān)管工作機制�����,進(jìn)一步明確和規(guī)范廣東省內(nèi)的醫(yī)療器械臨床試驗監(jiān)管的工作程序及檢查標(biāo)準(zhǔn)�。
??廣東省醫(yī)療器械臨床試驗機構(gòu)現(xiàn)狀及監(jiān)管基礎(chǔ)
??截至2022年4月15日�����,廣東省共有114家醫(yī)療器械臨床試驗機構(gòu)在國家藥監(jiān)局醫(yī)療器械臨床試驗機構(gòu)備案管理信息系統(tǒng)中完成備案�,數(shù)量居全國前列(見圖1)。分年度看���,2018年����,即《醫(yī)療器械臨床試驗機構(gòu)條件和備案管理辦法》施行的第一年����,廣東省醫(yī)療器械臨床試驗機構(gòu)數(shù)量備案最多,達(dá)到69家��,之后逐年遞減�,在2022年到達(dá)平臺期(見圖2)。從地區(qū)看�����,主要集中分布在珠三角區(qū)域,其中廣州44家����,占全省醫(yī)療器械臨床試驗機構(gòu)總數(shù)的38.6%�����;深圳31家�,占比27.2%;佛山��、東莞分別有10家���、5家(見圖3)���。上述4市的機構(gòu)數(shù)量約占全省的4/5。
??
??圖1
??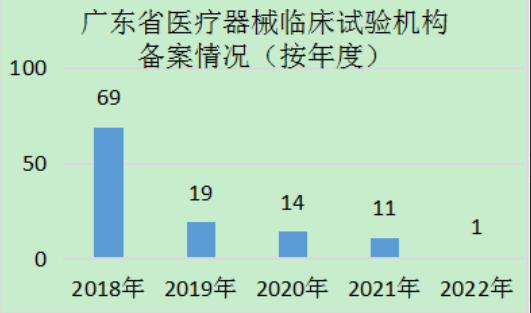
??圖2
??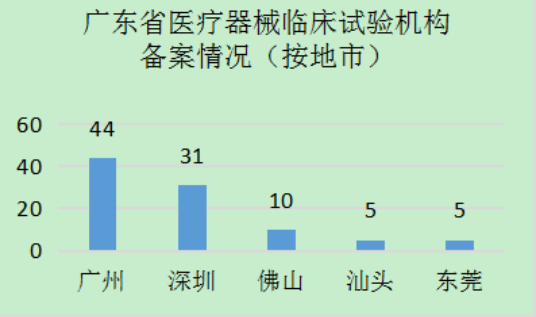
??圖3
??2017年以來����,廣東省醫(yī)療器械臨床試驗項目備案維持高位增長,年平均新增備案項目接近400個���。從產(chǎn)品類型看����,醫(yī)療器械項目年平均新增備案約140個,體外診斷試劑項目年平均新增備案約260個���;從管理類別看��,二����、三類項目年平均新增備案大致相等���,約200個���。
??廣東省醫(yī)療器械臨床試驗監(jiān)管成效
??2017年以來,廣東省藥監(jiān)部門積極探索醫(yī)療器械臨床試驗監(jiān)管方式���,通過運用互聯(lián)網(wǎng)+�、加強宣傳��、強化行業(yè)自律等措施,取得了顯著成效���。
??運用互聯(lián)網(wǎng)+��,醫(yī)療器械臨床試驗備案全程網(wǎng)辦��。2017年下半年起�����,廣東省藥監(jiān)部門通過優(yōu)化完善全省許可信息系統(tǒng)����,實現(xiàn)備案無紙化網(wǎng)上辦理����,申辦者足不出戶即可在業(yè)務(wù)受理當(dāng)天完成備案或備案變更���,縮減了往返時間及成本�����,極大提高了辦事效率��。沉淀的格式化大數(shù)據(jù)也為常態(tài)化精準(zhǔn)監(jiān)督抽查奠定了良好的基礎(chǔ)�����。通過信息化管理方式���,廣東省藥監(jiān)部門可以隨時根據(jù)監(jiān)管需求�,按照備案類型��、管理類別���、產(chǎn)品類型等要求檢索某一時間段的醫(yī)療器械臨床試驗項目��,有針對性地開展監(jiān)督抽查���。
??加強宣傳發(fā)動,鼓勵引導(dǎo)省內(nèi)臨床試驗機構(gòu)備案���。2017年底�,《醫(yī)療器械臨床試驗機構(gòu)條件和備案管理辦法》發(fā)布后�����,廣東省藥監(jiān)部門與衛(wèi)生主管部門加大對辦法的宣貫力度,聯(lián)合發(fā)文鼓勵省內(nèi)符合條件的醫(yī)療機構(gòu)積極開展醫(yī)療器械臨床試驗機構(gòu)備案��。截至2022年4月中旬��,廣東已有超過100家機構(gòu)在國家藥監(jiān)局醫(yī)療器械臨床試驗機構(gòu)備案系統(tǒng)中完成備案��,數(shù)量居全國前列�����,珠海市人民醫(yī)院以“械臨機構(gòu)備201800001”成為全國首家備案的機構(gòu)�。
??強化行業(yè)自律,籌劃成立全國首個公益性專委會�����。2019年1月����,廣東省藥監(jiān)局依托廣東省醫(yī)療器械管理學(xué)會成立醫(yī)療器械臨床試驗專業(yè)委員會����,專委會以省內(nèi)各主要醫(yī)療單位的機構(gòu)辦管理人員為主體,吸納部分資深臨床醫(yī)生及個別醫(yī)療器械生產(chǎn)企業(yè)代表����,倡導(dǎo)法規(guī)研討和學(xué)術(shù)交流����。
??落實“四個最嚴(yán)”要求����,保障醫(yī)療器械臨床試驗真實規(guī)范。從2016年起���,廣東省藥監(jiān)部門按照“由省內(nèi)到省外�,由在審到在研�,由項目到機構(gòu),由二類到三類”的思路��,逐步常態(tài)化地開展醫(yī)療器械臨床試驗監(jiān)督抽查��,合理運用檢查結(jié)果�,不斷提高申辦方開展臨床試驗的規(guī)范性,強化醫(yī)療器械臨床試驗機構(gòu)的法律責(zé)任意識��,提升臨床試驗檢查人員的業(yè)務(wù)水平�����。同時,廣東省藥監(jiān)部門不斷加大監(jiān)督抽查力度��,檢查頻次在2019年度達(dá)到高值���。2020年���,因新冠肺炎疫情防控減少人員流動等原因,監(jiān)督抽查數(shù)量暫時維持原位�����。通過幾年的監(jiān)督抽查���,廣東省醫(yī)療器械臨床試驗機構(gòu)檢查覆蓋率已經(jīng)達(dá)到73%�,計劃未來2年內(nèi)實現(xiàn)全覆蓋�����。
??引入社會共治�,充實醫(yī)療器械臨床試驗檢查資源�����。臨床試驗監(jiān)管畢竟是新生事物,起步較晚���,檢查資源相對不足��。2019年5月����,廣東省藥監(jiān)局在醫(yī)療器械臨床試驗專業(yè)委員會基礎(chǔ)上�����,組建評估專家團(tuán)隊�,開創(chuàng)性地以政府購買服務(wù)的方式委托開展省內(nèi)醫(yī)療器械臨床試驗交叉檢查;2020年底�����,廣東省藥監(jiān)局組織開展省內(nèi)臨床試驗機構(gòu)監(jiān)督抽查����。評估專家團(tuán)隊作為第三方專業(yè)檢查評估機構(gòu)均為各主要醫(yī)療機構(gòu)的項目管理者,具備良好的專業(yè)素質(zhì)�,了解申報產(chǎn)品的技術(shù)特點,熟悉項目質(zhì)量控制的管理流程等�����。
??加強醫(yī)療器械臨床試驗監(jiān)管建議
??總結(jié)廣東省醫(yī)療器械臨床試驗管理經(jīng)驗,建議各級監(jiān)管部門細(xì)化職責(zé)分工���、加強對臨床試驗機構(gòu)和項目的監(jiān)督管理���、完善檢查結(jié)果處理、推進(jìn)監(jiān)管能力建設(shè)�����,更好進(jìn)行臨床試驗監(jiān)管����。
??經(jīng)過幾年備案,各省份醫(yī)療器械臨床試驗機構(gòu)數(shù)量已趨于平穩(wěn)����,藥品監(jiān)管部門應(yīng)該實現(xiàn)全覆蓋檢查。從風(fēng)險管控角度講���,既往未獲得藥物臨床試驗資質(zhì)的臨床試驗機構(gòu)����,其從業(yè)經(jīng)驗相對欠缺���、質(zhì)量管控較難保障�����,監(jiān)管部門迫切需要及時掌握其實際情況��,迫切需要提高其法規(guī)意識����。因此��,對于備案機構(gòu)數(shù)量較多的省份�,建議首先覆蓋檢查該類機構(gòu);對于原已具備藥物臨床試驗資質(zhì)的機構(gòu)����,可以與藥物臨床試驗機構(gòu)合并檢查,提高檢查效率����。
??醫(yī)療器械臨床試驗項目不僅數(shù)量多,而且持續(xù)新增��,一個項目從備案到實施再到結(jié)題,往往要歷經(jīng)數(shù)月甚至長達(dá)數(shù)年�����。建議以監(jiān)督抽查的方式�����,按照每年隨機抽取不少于20%比例對項目開展現(xiàn)場檢查�����,盡量涵蓋醫(yī)療器械和體外診斷試劑兩類產(chǎn)品��,優(yōu)先選取在新機構(gòu)開展的新項目��;對于注冊審評審批����、嚴(yán)重不良事件及投訴舉報信訪等涉及到的問題線索,開展有因飛行檢查�����。
??發(fā)現(xiàn)臨床試驗機構(gòu)不具備《醫(yī)療器械臨床試驗機構(gòu)條件和備案管理辦法》規(guī)定的條件和要求的,應(yīng)當(dāng)責(zé)令其限期整改并在整改完成后提出復(fù)查申請����,整改期內(nèi)不得承接新的醫(yī)療器械臨床試驗項目���,復(fù)查仍未通過的�����,取消其備案��,并通報同級衛(wèi)生健康主管部門����;項目檢查時發(fā)現(xiàn)存在真實性問題的����,監(jiān)管部門應(yīng)在詳盡調(diào)查事由、公正厘清責(zé)任并充分聽取申辯的基礎(chǔ)上��,依據(jù)《行政許可法》《醫(yī)療器械監(jiān)督管理條例》的規(guī)定對責(zé)任方作出嚴(yán)肅處理��。
??此外�,監(jiān)管部門還應(yīng)當(dāng)建立適應(yīng)本行政區(qū)域醫(yī)療器械產(chǎn)業(yè)發(fā)展實際的職業(yè)化專業(yè)化醫(yī)療器械臨床試驗檢查員隊伍,不斷加大法規(guī)業(yè)務(wù)培訓(xùn),不斷提高檢查能力水平���。建議以省為單位成立行業(yè)自律組織���,加強法規(guī)宣貫培訓(xùn),引導(dǎo)強化行業(yè)自律���。
??相關(guān)鏈接:
??廣東省醫(yī)療器械臨床試驗監(jiān)管主要流程
??一�、現(xiàn)場檢查前準(zhǔn)備
??在正式實施現(xiàn)場檢查前的2周至4周內(nèi)�,通過政務(wù)網(wǎng)站發(fā)布通告,明確檢查對象�����。提前準(zhǔn)備檢查所需的現(xiàn)場檢查表格文書及常用法規(guī)文件匯編��。機構(gòu)檢查的�,應(yīng)準(zhǔn)備該機構(gòu)在備案信息系統(tǒng)中的填報信息;項目檢查的���,應(yīng)準(zhǔn)備該項目的臨床試驗備案表����。
??印發(fā)工作通知,成立檢查小組���、分配檢查任務(wù)�,明確具體檢查日期及聯(lián)系方式�����。協(xié)調(diào)聯(lián)系并書面要求有關(guān)專家���,對于機構(gòu)檢查的,優(yōu)選三級甲等公立醫(yī)院機構(gòu)辦公室管理者����;對于項目檢查的,優(yōu)選對口專業(yè)/領(lǐng)域的副高以上職稱臨床醫(yī)生/檢驗師/護(hù)師���。
??制作現(xiàn)場檢查通知書��,在現(xiàn)場檢查實施3天前����,通知相應(yīng)的臨床試驗機構(gòu)或/及申辦者��,必要時抄送所在地省級藥品監(jiān)督管理部門。
??二��、檢查組成員構(gòu)成
??每個檢查小組由4-5人組成��,其中組長1名���、組員3~4名���。組長負(fù)責(zé)與被檢單位溝通聯(lián)系,確定具體檢查行程安排����。組長宜為處級干部,組員包括省藥監(jiān)局醫(yī)療器械監(jiān)管人員�����、申辦者所在地市級監(jiān)管人員�����、技術(shù)審評/檢驗檢測人員�,以及外邀臨床專家。
??三��、檢查時間安排
??原則上對每家醫(yī)療器械臨床試驗機構(gòu)或每個醫(yī)療器械臨床試驗項目的檢查時間不超過2天,省內(nèi)檢查往返路程包含在內(nèi)�。開展省外檢查的,一般在一周內(nèi)完成2個被檢對象的現(xiàn)場檢查��。
??四��、現(xiàn)場檢查環(huán)節(jié)
??預(yù)備會?����,F(xiàn)場檢查前一天����,檢查組組長組織全體檢查人員召開預(yù)備會�,熟悉檢查任務(wù)和檢查方案、研究確定檢查方法��,落實相關(guān)紀(jì)律要求��。
??首次會議�。檢查當(dāng)天,檢查組向臨床試驗機構(gòu)出示檢查通知�、通報檢查組人員組成、檢查事由���、現(xiàn)場要求����。申辦方人員同時到會。
??現(xiàn)場檢查�����。檢查人員調(diào)閱臨床試驗機構(gòu)保存的臨床試驗方案����、臨床試驗報告、病例報告表以及其他原始試驗資料��,全面����、真實、客觀地記錄現(xiàn)場檢查情況及存在問題�。需要取證的,檢查組可采用不同的方式進(jìn)行證據(jù)留存����,如復(fù)印、錄音��、攝像等。
??綜合會議���。組長主持召開綜合會議�,檢查組成員匯報各自發(fā)現(xiàn)的問題����,檢查組共同討論并確認(rèn),如實�、清晰地撰寫醫(yī)療器械臨床試驗監(jiān)督檢查意見表。
??末次會議����。檢查組向臨床試驗機構(gòu)、申辦者通報檢查情況����,臨床試驗機構(gòu)和申辦者作解釋說明���,相關(guān)文件簽字蓋章等����。
??五���、現(xiàn)場檢查內(nèi)容
??醫(yī)療器械項目按《國家藥監(jiān)局綜合司關(guān)于印發(fā)醫(yī)療器械臨床試驗檢查要點及判定原則的通知》中的檢查要點進(jìn)行檢查�����;體外診斷試劑項目按《體外診斷試劑臨床試驗技術(shù)指導(dǎo)原則》進(jìn)行檢查�;醫(yī)療器械臨床試驗機構(gòu)主要按《國家食品藥品監(jiān)督管理總局 國家衛(wèi)生和計劃生育委員會關(guān)于發(fā)布醫(yī)療器械臨床試驗機構(gòu)條件和備案管理辦法的公告》進(jìn)行檢查。
??六�、研定處理意見
??臨床試驗機構(gòu)檢查。對檢查組返回的材料進(jìn)行綜合研判�����,根據(jù)存在問題的嚴(yán)重程度及風(fēng)險等級擬定處理建議��,必要時組織專家進(jìn)行論證��。及時將處理意見書面反饋被檢查機構(gòu)����。
??臨床試驗項目檢查。對于存在合規(guī)性問題的�����,書面反饋發(fā)現(xiàn)問題及處理意見�,要求申辦者會同臨床試驗機構(gòu)共同分析原因�����、制定預(yù)防糾正措施�、提交整改報告�����。在審項目存在真實性問題的�,依法作出不予注冊行政許可決定,1年內(nèi)不再受理相同項目的注冊申請��。
??七����、資料歸檔要求
??收回整改報告,匯總形成階段性監(jiān)督檢查報告��。及時整理方案����、通知����、現(xiàn)場檢查記錄���、專家討論意見等完整材料后,編目存檔�����。按照機關(guān)檔案管理辦法有關(guān)規(guī)定保存10年���。